
Research
□ 機械受容チャネルのゲーティング機構
はじめに
血管内皮細胞は,血流によるせん断応力などの機械刺激に対し多彩な機能応答を起こすことが知られています(図1). これらの機械受容・応答は,局所の循環動態制御に重要な役割を果たすと考えられていますが,その分子機構を含めた メカニズムの詳細はよくわかっていません.現在実体がわかっている機械受容機構はMS(Mechano-Sensitive)チャネル と呼ばれる,MscLを含む,原核細胞の細胞膜表面に存在するイオンチャネル(膜タンパク)の一部のみです.一方,近年, 真核細胞のカチオンチャネルのアミノ酸配列が決定されており,MscLと酷似した高次構造を持つことが予見されています. つまり,真核細胞の機械受容メカニズムの一形態として,機械刺激による膜タンパクの物理的変形により,イオンチャネルの ゲーティングが制御されていることが考えらます.
MD数値シミュレーション
本研究室では,せん断応力刺激に対する内皮細胞の機械受容・応答機構の説明をナノスケールの力学的な視点から試みるため, 構造の詳細が明らかなMscLを用いたMD(分子動力学)シミュレーションを行うことで(図2),せん断応力刺激によるMscL の経時的な形態変化について調べました.図2は計算に用いた分子モデルを示します.周囲を水で満たした細胞膜 (脂質2重層)の中にイオンチャネルの膜タンパクを浮遊させ,初期状態を作るために,内部応力を解放させるための緩和計算を行った後, 細胞膜に対し図の水平方向に伸長・圧縮の応力を負荷するシミュレーションを行いました.MD計算にはNAMD (https://www.ks.uiuc.edu/Research/namd/)を用い,MscLの分子モデルにはProtain Data Bank (https://www.rcsb.org/)の結晶構造データを使用しました.
せん断刺激による膜タンパクの変形
MDシミュレーションの結果,イオンチャネルの開孔面積が伸張負荷で約1.2倍,圧縮負荷では約0.9倍となる結果が得られました (図3).さらに,イオンチャネルの内部構造(図4)について調べると,伸長刺激時にはチャネルの通路が広くなり, 圧縮時刺激時には狭められる様子が再現されました.このことから,内皮細胞の上流部では, 周期的伸張刺激を受けることでイオンチャネルが開き,下流部では圧縮刺激を受けることにより閉じることが予想されます.
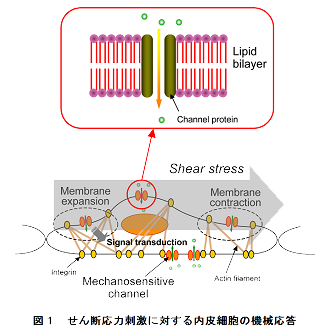
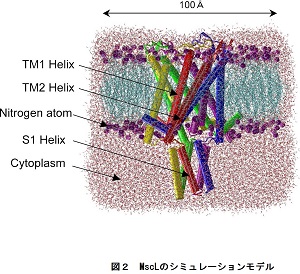
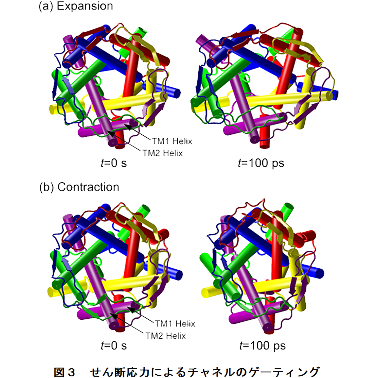
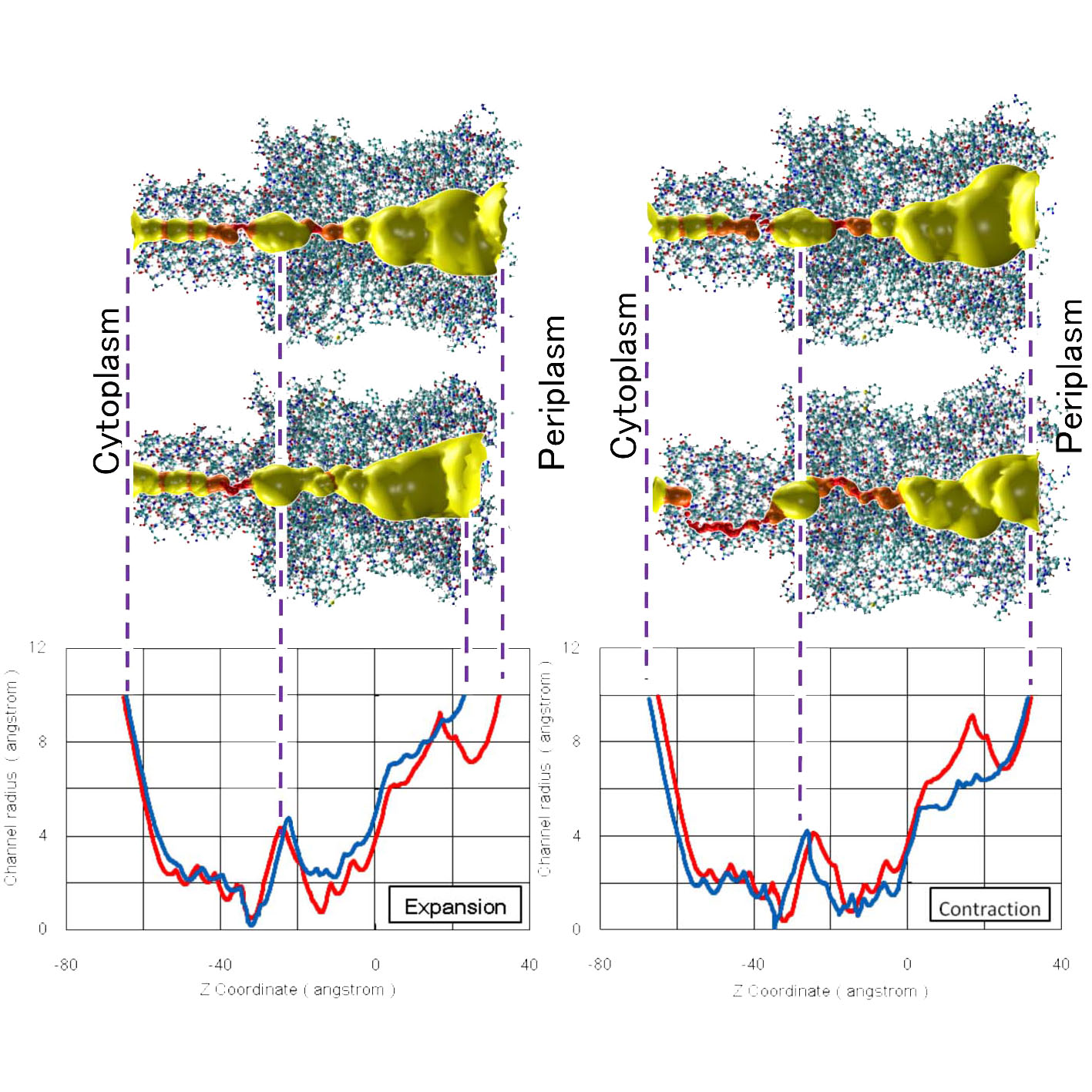
図1 図2 図3 図4
- 担 当:
- 多田教授
- 論 文:
- Shigeru Tada, Satoshi Akiyama: Modeling of Mechanosensitive Channel Gating in Response to Wall Shear Stress, Journal of Biorheology, Vol. 23, pp.87-94, 2009.
<< Research Menu