研究内容「タンパク質の構造安定性」
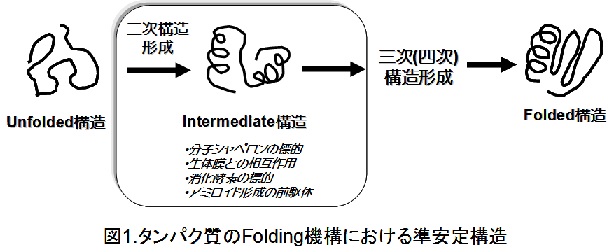
タンパク質のfolding機構に関する研究は、タンパク質の立体構造構築原理やタンパク質の凝集機構の解明のためにこれまで多くの研究が行われてきた。特に、1990年代以降、タンパク質のfolding過程の速度論的解析により多くの準安定構造(例えばモルテングロビュール状態)の存在が明らかにされてきた。この準安定構造は、近年、分子シャペロンの標的、消化酵素の標的、生体膜の相互作用、アミロイドの前駆体として、非常に注目されている(図1)。従来のタンパク質の準安定構造の検出方法には、NMR法、CD分光法、蛍光分光法、小角X線散乱(SAXS)法を用いたH/D交換反応、Stopped-Flow測定、多孔性シリカを用いたゾル―ゲル法などの特殊な手法が用いられてきた。しかしながら、これらの手法の多くは、測定条件の制限(例えば、濃度の制約や単一構造のみの追跡)があるため、タンパク質の準安定構造の検出は容易ではないのが現状である。それ故、タンパク質の準安定構造は、どのような構造をとるのか?また、どのような経路で形成されるか?など未だ明確でない点が多い。もし、あらゆるタンパク質のfolding過程における準安定構造の形成経路がシンプルな手法で明らかになれば、タンパク質のmisfoldingやaggregation機構、また分子シャペロン機構の解明にも繋がり、生物物理学のみならず、生化学や医学の分野における発展に大いに期待できる。
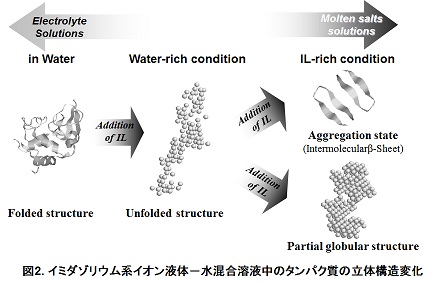
一方、我々は、溶融塩的性質を示す濃厚IL水溶液中でウシミルクβ-lactoglobulinのfolding過程におけるα-helix構造の形成が、disordered構造を経由して生じる事実を見出した(J. Phys. Chem. B, 117, 10142 (2013))。また、希薄IL水溶液中で一度unfoldさせたchiken egg whilte lysozymeを更なるILの添加に寄ってrefoldさせることを発見した(J. Phys. Chem. B, 116, 11092 (2012))(図2)。これらの結果は、次に示すタンパク質の準安定構造を検出可能する様々な濃厚IL水溶液の性質によって生じると考えている。
(i) 低誘電率化→タンパク質のhelix構造を安定化する。
(ii) 高粘性率→タンパク質の構造転移をtrapすることができる。
(iii) カチオンとアニオンの組み合わせ→水への溶解性やタンパク質の凝集を制御する。
(iv) カチオンのアルキル鎖の変化→水和できる水分子の大きさを調節できる。
このような濃厚IL水溶液の持つユニ-クな特徴・結果は、タンパク質のfolding過程における準安定構造及びその形成経路の検出に対して非常に有用な新規溶媒であり、且つシンプルな手法によって可能になるのではないかと考える。上述したように従来のタンパク質のfolding過程における準安定構造の検出には、H/D交換測定やStopped-flow測定、高速分光測定などの特殊な手法が必要であった。しかしながら、従来の方法では検出できなかった準安定構造への転移過程を、『イオン液体:IL』を用いること、つまりシンプルな手法でタンパク質のfolding過程の準安定構造とその経路を検出できることが大いに期待できる。
【関連する論文】
・High Ionic Liquid Concentration-induced Structural Change of Protein in Aqueous Solution: A Case Study of Lysozyme (J. Phys. Chem. B, 116, 11092-11097 (2012)
・ Ionic Liquid-induced Formation of α-Helical Structure of β-Lactoglobulin(J. Phys. Chem. B, 117, 10142-10148 (2013))
・Protein Aggregation and Partial Globular State of Proteins in Aqueous 1-Alkyl-3-methylimidazolium Nitrate
Solutions (Chem. Phys. Lett., 600, 56-60 (2014))
・Interaction Site between the Protein Aggregates and Thiocyanate Ion in Aqueous Solution: A Case Study of 1-Butyl-3-methylimidazolium Thiocyanate (J. Phys. Chem. B, 119, 6536-6544 (2015))
・Effect of Ethylammonium Halides on Helix Formation of Proteins (Chem. Phys. Lett., 759, 137970 (2020))
我々は、カチオンとアニオンのみから構成されるイオン液体をアミロイド凝集体の形成を防ぐ抑制剤及び凝集体を可溶化する可溶化剤としての性能を検討しています。
これまでに、insulin、Aβ peptideのアミロイド凝集体を対象にイオン液体の持つ抑制能と可溶化能を分光学的手法を用いて評価してきました。ある傾向としては、アンモニウム系イオン液体は抑制能が高いものの、アニオン種によっては促進効果を持つものもあることが分かってきました。一方、可溶化効果としては、アンモニウム系イオン液体よりも、イミダゾリウム系イオン液体の方が可溶化能が高いことが分かってきました。現在、他のアミロイド凝集体への効果を検討し、どのような組み合わせが最適な抑制剤や可溶化剤になりうるのかを検証しています。
【関連する論文】
・Supression Effect on the Formation of Insulin Amyloid by the Use of Ionic Liquid (ACS Sustain. Chem. Eng., 4, 422-428 (2016))
・Dissolutin of Amyloid Aggregates in Aqueous Ionic Liquid Solutions: A Case Study of Insulin Amyloid (Aust. J. Chem., 72, 81-86 (2018))
・Recovery and Cryopresrvation of Insulin Amyloid using Ionic Liquids (J. Mol. Liq., 272, 1019-1024 (2018))
・Aggregation Selectivity of Amyloid β1-11 in Aqueous Ionic Liquid Solution (Peptide Sci., 112, e24138 (2020))
・Fomation of α-Sycnulein Aggregates in Aqueous Ethylammonium Nitrate Solutions (Biopolymers, 111, e23352 (2020))
【関連する論文】
・Pressure Stability of α-Helix Structure in de novo Designed Protein Studied by FTIR Spectroscopy (Biopolymers, 85, 185-188 (2007))
・Relationship between the Hydrophobic Interactions and Secondary Structure Stability for Trpzip β-Hairpin
Peptides (Biochemistry, 48, 1543-1552 (2009))
・Geometry and Efficancy of Trp/Trp, Trp/Tyr, and Tyr/Tyr Aromatic Interaction in Cross Strand Positions a
Designed β-Hairpin Peptides(Biochemistry, 49, 4705-4714 (2010))
・Pressure-indcued Structural Changes of Alanine Oligopeptides in Aqueous Solutions (High Press. Res., 39, 202-209 (2019))

イオン液体―水混合溶液中におけるタンパク質の準安定構造の検出
『イオン液体(Ionic Liquid: IL)』は、有機カチオンとアニオンのみから成る100℃以下で液体として存在する塩であり、カチオンとアニオンの組み合わせにより、水への溶解性などの溶媒特性を自由にデザインできる特徴を持つ。また、ILと水との混合溶液の誘電率や粘性率などの溶液特性は、希薄IL水溶液では電解質水溶液的な性質を示し、濃厚IL水溶液で溶融塩的な性質を示すという特徴を示す(H. Weingärtner, et al., Phys. Chem. Chem. Phys., 14, 415 (2012))。これまで、ILと水との混合溶液中におけるタンパク質の構造安定性や活性に関する研究は、いくつか報告されているものの、分学的測定の制限により、希薄IL水溶液(~数M)での研究が多い。これらの結果で希薄IL水溶液中におけるタンパク質は、いわゆるタンパク質の塩効果と同様の傾向を示し、Hofmeister系列(タンパク質の安定化、不安定化イオンの指標)に従うと報告されている(D. Constantinescu, et al., Angew. Chem. Int. Ed., 46, 8887 (2007))。一方、我々は、溶融塩的性質を示す濃厚IL水溶液中でウシミルクβ-lactoglobulinのfolding過程におけるα-helix構造の形成が、disordered構造を経由して生じる事実を見出した(J. Phys. Chem. B, 117, 10142 (2013))。また、希薄IL水溶液中で一度unfoldさせたchiken egg whilte lysozymeを更なるILの添加に寄ってrefoldさせることを発見した(J. Phys. Chem. B, 116, 11092 (2012))(図2)。これらの結果は、次に示すタンパク質の準安定構造を検出可能する様々な濃厚IL水溶液の性質によって生じると考えている。
(i) 低誘電率化→タンパク質のhelix構造を安定化する。
(ii) 高粘性率→タンパク質の構造転移をtrapすることができる。
(iii) カチオンとアニオンの組み合わせ→水への溶解性やタンパク質の凝集を制御する。
(iv) カチオンのアルキル鎖の変化→水和できる水分子の大きさを調節できる。
このような濃厚IL水溶液の持つユニ-クな特徴・結果は、タンパク質のfolding過程における準安定構造及びその形成経路の検出に対して非常に有用な新規溶媒であり、且つシンプルな手法によって可能になるのではないかと考える。上述したように従来のタンパク質のfolding過程における準安定構造の検出には、H/D交換測定やStopped-flow測定、高速分光測定などの特殊な手法が必要であった。しかしながら、従来の方法では検出できなかった準安定構造への転移過程を、『イオン液体:IL』を用いること、つまりシンプルな手法でタンパク質のfolding過程の準安定構造とその経路を検出できることが大いに期待できる。

【関連する論文】
・High Ionic Liquid Concentration-induced Structural Change of Protein in Aqueous Solution: A Case Study of Lysozyme (J. Phys. Chem. B, 116, 11092-11097 (2012)
・ Ionic Liquid-induced Formation of α-Helical Structure of β-Lactoglobulin(J. Phys. Chem. B, 117, 10142-10148 (2013))
・Protein Aggregation and Partial Globular State of Proteins in Aqueous 1-Alkyl-3-methylimidazolium Nitrate
Solutions (Chem. Phys. Lett., 600, 56-60 (2014))
・Interaction Site between the Protein Aggregates and Thiocyanate Ion in Aqueous Solution: A Case Study of 1-Butyl-3-methylimidazolium Thiocyanate (J. Phys. Chem. B, 119, 6536-6544 (2015))
・Effect of Ethylammonium Halides on Helix Formation of Proteins (Chem. Phys. Lett., 759, 137970 (2020))
アミロイド凝集体形成の抑制及び可溶化剤の開発
アミロイド凝集体は、蛋白質のmisfoldingによって生じる分子間β-sheet構造からなる規則性凝集体であり、アルツハイマー病等の神経変性疾患を含む様々なアミロイドーシスの原因物質として知られています。また、このようなアミロイド凝集体は、大腸菌や酵母を用いた遺伝子組み換え蛋白質の発現の際に生じる封入体構造としても観測され、目的蛋白質の回収率をを低下させる原因としても知られています。このような難溶性蛋白質凝集体の抑制や可溶化は、医薬品分野や蛋白質工学を含む幅広い分野で重要な課題とされています。我々は、カチオンとアニオンのみから構成されるイオン液体をアミロイド凝集体の形成を防ぐ抑制剤及び凝集体を可溶化する可溶化剤としての性能を検討しています。
これまでに、insulin、Aβ peptideのアミロイド凝集体を対象にイオン液体の持つ抑制能と可溶化能を分光学的手法を用いて評価してきました。ある傾向としては、アンモニウム系イオン液体は抑制能が高いものの、アニオン種によっては促進効果を持つものもあることが分かってきました。一方、可溶化効果としては、アンモニウム系イオン液体よりも、イミダゾリウム系イオン液体の方が可溶化能が高いことが分かってきました。現在、他のアミロイド凝集体への効果を検討し、どのような組み合わせが最適な抑制剤や可溶化剤になりうるのかを検証しています。
【関連する論文】
・Supression Effect on the Formation of Insulin Amyloid by the Use of Ionic Liquid (ACS Sustain. Chem. Eng., 4, 422-428 (2016))
・Dissolutin of Amyloid Aggregates in Aqueous Ionic Liquid Solutions: A Case Study of Insulin Amyloid (Aust. J. Chem., 72, 81-86 (2018))
・Recovery and Cryopresrvation of Insulin Amyloid using Ionic Liquids (J. Mol. Liq., 272, 1019-1024 (2018))
・Aggregation Selectivity of Amyloid β1-11 in Aqueous Ionic Liquid Solution (Peptide Sci., 112, e24138 (2020))
・Fomation of α-Sycnulein Aggregates in Aqueous Ethylammonium Nitrate Solutions (Biopolymers, 111, e23352 (2020))
水溶液中のタンパク質、ペプチドの立体構造安定性(立体構造構築原理)
上述したようなイオン液体中のタンパク質の構造転移を理解するには、水溶液中におけるタンパク質やそのモデルペプチドであるオリゴペプチドの立体構造安定性に関する研究が非常に重要である。我々は、タンパク質のモデルペプチドや球状タンパク質の立体構造安定性に及ぼす温度、圧力、塩効果を行い、熱力学的解析を行っている。これまでの研究結果から、タンパク質表面に位置しているα-Helix構造は低温、高圧下では非常に安定であり、タンパク質内部に位置しているα-Helix構造は逆に不安定化していることを見出した。また、Helix構造だけではなく、Hairpin構造を持つペプチドの構造安定性についても熱力学的解析を行い、二次構造と三次構造の相関について検証をしている。【関連する論文】
・Pressure Stability of α-Helix Structure in de novo Designed Protein Studied by FTIR Spectroscopy (Biopolymers, 85, 185-188 (2007))
・Relationship between the Hydrophobic Interactions and Secondary Structure Stability for Trpzip β-Hairpin
Peptides (Biochemistry, 48, 1543-1552 (2009))
・Geometry and Efficancy of Trp/Trp, Trp/Tyr, and Tyr/Tyr Aromatic Interaction in Cross Strand Positions a
Designed β-Hairpin Peptides(Biochemistry, 49, 4705-4714 (2010))
・Pressure-indcued Structural Changes of Alanine Oligopeptides in Aqueous Solutions (High Press. Res., 39, 202-209 (2019))
shop info店舗情報
防衛大学校 応用化学科 応用物理化学研究室
〒239-8686
神奈川県横須賀市走水1-10-20
TEL.046-841-3810
FAX.046-844-5901